光合作用的主要反应,是在反应中心进行的由光驱使的电荷分离。反应中心是一种由完整的膜蛋白质和辅助因子组成的络合体。最近确定了两种光合细菌反应中心的结晶结构,从而为定量认识光合作用的最初的电子转化过程提供了基础。
光合作用是一种电磁能(光)转化成化学能的生物学过程。地球上的生命获得的所有能源都是来自这一过程。光合作用由两大类有机体来完成:例如释放氧的绿色植物和不释放氧的光合细菌。细菌的光合作用过程简单得多,例如细菌只含有一种光合系统,而绿色植物却含两种光合系统,即光合成系统Ⅰ和Ⅰ。20年以来,在对较简单的细菌光合作用系统的分子结构和功能的认识方面,已取得了许多进展;其中许多方面,也同样适合于植物的光合成器官。在此,我们集中讨论细菌光合作用的最初过程。
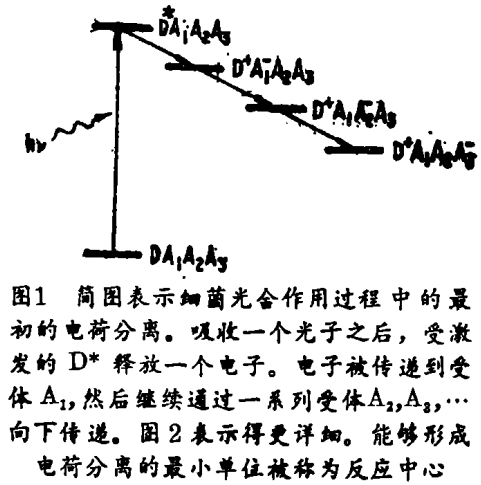
细菌光合作用的最初过程是一种跨膜电荷分离,图1是简略示意图。吸收一个光子,激发最初的电子供体,即一个色素分子,使它由基态D到激发态D*;紧接着,电子由D*转化到受体A,继而穿梭般通过受体A1,A2…。而且D+上丢失的电子由第二个供体所代替(图1未示出)。这个电子转化链的最显著特征,就是一个光子的吸收,导致一个分离电荷对的形成;也就是说,该过程的量子产额接近其最大值,在模式系统的光化学反应中造成一致的未匹配状态。
能够形成电荷分离的最小的结构单位,是一个被命名为反应中心的完整膜络合物。1932年首次提出了它的存在;1952年得到了它在细菌中存在的直接的光谱证据。但只是到了1970年前后,这种能够完成电荷分离的络合物,才被从紫色光合细菌球形红色杆菌[Rhodobacter(Rb)Spaeroides]中分离出来。20年来,对这种反应中心的结构和作用模式的认识,取得了巨大进展,这些进步,是综合了应用几项生物化学和生物物理学技术的结果。是这些技术,提供了反应中心的静态和必威在线网站首页网址 结构功能的有关信息。最近,利用X - 射线结晶学,对组成绿色红假单胞菌[Rhodopseudomonas(RPS)、Viridis和Rb、Sphaeroides]的反应中心的各种分子供体及受体的空间排列进行了高分辨率的(<3?)测定,为定量分析最初电荷分离过程中电子传递反应的动力学铺平了道路。
反应中心的构成
反应中心是一种由三种亚基和辅助因子组成的完整膜蛋白质。辅助因子包括4个细菌叶绿素,两个细菌脱镁叶绿素,两个醌和一个非血红素高自旋Fe2+。是用光谱学方法,对最初反应物进行了测定。尤其是,最初步骤的产物是未配对的电子,所以利用了电子顺磁共振和其有关的电子 - 核双共振以及光谱学技术描述最初反应中的反应物和起始顺序9由此以来,到70年代中期,就确定了最初的供体楚一种细菌叶绿素二聚物,第一和第二个受体都是醌类,一个中介体受体是细菌脱镁叶绿素。在Rb. Spaeroides中第二个供体是一个外原水溶性细胞色素C2;而在RPS. Viridis中的第二个供体,是一个多血红素细胞色素,成为反应中心的一个完整部分。
电子传递函数和能量学
可把反应中心视为一种为进行有效的电子传递把各种辅助因子(反应物)固定在适当位置上的蛋白质框架。用时间分辨的分光术所测出的个别电子传递反应的动力学总结在图2中。联系图1所讨论的高量子产额,每一个向前的反应要比向后的竞争反应(电荷重组反应)快2 ~ 3个数量级。这种高量子产额所付出的代价,是明显损失能量60 ~ 70%,在形成最后的电荷分离状态时,要定量认识辅助因子之间电子的传递速度,绝非易事。由于这些速度取决于辅助因子的取向、辅助因子之间的距离以及辅助因子的不同原子位置上的电子密度。为搞清这些问题,就必须先获得反应物的空间和电子结构。
空间结构
探测大分子的空间结构,所选用的方法是X - 射线衍射。这种技术,要求相对大的(几十毫米)排列有序的单结晶。直到最近,一般认为不能使完整的膜蛋白质结晶,因为存有随机排列的去垢剂分子,会干扰相同成分有序排列的形成。1980年:事实粉碎了以往的迷信。成功结晶了细菌视紫质和Porin。以前的观点所以错误,是没能认识到大分子的许多接触点是亲水的,所以就不含去垢剂分子了。
在原子分辨水平上,求出了RPS. Viridis反应中心的蛋白质的一级结构,精确度为2.9 ?,最近又提高到2.3 ?。作为一种测定技术的先进水平标志,戴森霍费(J. Deisenhofer)、R. 休伯(R. Huber)和H. 米歇尔(H. Michel)为此获得了1988年度诺贝尔化学奖。此后不久,Rb. Spaeroides的反应中心被结晶成功,而且对它的结构的测定,分辨率达2.8 ?。其反应中心的X - 射线衍射的最初相位和一级结构,是以RPS. Viridis反应中心为坐标,用分子替换方法得到的。
Rb. Sphqeroides和RPS、Viridis的反应中心的空间结构是相似的。我们在此列举两者的主要结构特征,强调指出两者之间的一致性。它们之间的主要区别,在BPS. Viridis中有一个如外的含4个血红素族的细胞色素亚基;细菌叶绿素b取代了细菌叶绿素a,第一个醌类,是甲基苯醌(维生素K)而不是泛醌(辅酶Q)。
辅助因子排列成两股,即A股和B股(在RPS. Viridis中命名为L和M)。通过一个双折对称轴,两股近似地对应相关,由铁离子为中心,向外扩展,逐渐靠近有关的形成二聚体的细菌叶绿素(DA和DB)。在两股中相关等价辅助因子的双配位基达到最佳之后,等价原子之间的平方根偏差约为1?。
虽然A和B股是近似对称的,但电子传递的速度,沿A股的起码要快20倍。这种差别,似乎是由于辅助因子和蛋白质亚基两方面双折对称所产生的偏差较小所引起的。虽然没有预计到有对称相关的两股存在,可色素沿A股的排列方式与按光谱学测定所推测的电子路线是相吻合的。细菌叶绿素DA和DB在环Ⅰ位置上重叠,形成了细菌叶绿素二聚体,已由光谱学技术鉴别为主要的供体。环中心间的距离是7.0 ?。在RPS、Viridis的环1平面之间的平均距离约3 ?。在Rb. Spaeroides内约是3.5?。其次每一股紧跟着的是细菌叶绿素单体BA和BB,关系到有力地促进电子由供体向细菌脱镁叶绿素ΦA和ΦB的传递。光学研究的结果指示,其中与中介体受体有关,而其他并不涉及电子传递。两个醌QA和QB分别为第一和第二个受体。鉴于QA为第一个醌,主要是根据RPS、Viridis结晶的X - 射线结构。这种结晶具光化学活性,就是说,在光照条件下,它们形成D+QA-,但缺乏QB。结构指示,活性细菌脱镁叶绿素是在A股上,因为它最靠近第一个受体QA。Fe2+位于两个醌之间,它和4个组氨酸及一个谷氨酸的二合配位体相配位。这5个残基,在RPS. Viridis和Rb. Sphaeroides之间是一致的。配合基体形成了一个倾斜的八面体,在Rb. Sphaeroides中的Fe2+靠QB比靠QA近约2 ?,正如按光谱学测定所预计的一样。
反应中心蛋白质骨架的结构和根据疏水氨基酸残基在每一亚基顺序中分布情况所预测的结果是一致的。X - 射线衍射结果指示,存有11个跨膜螺旋,L和M亚基各有5个,H亚基1个。L和M链紧靠在一起。LM复合物形成一个圆柱式核心,有一个椭圆横切面,距中心的距离约40?和70?。在核中心区含有由4个螺旋组成的螺旋束,每一个亚基提供两个螺旋,而每一个螺旋含有一个和铁配位的组氨酸残基。由此可见,金属离子在稳定核区中担负重任。正如预测的一样,所有辅助因子都和LM复合物有关。
LM复合体也有一个双折的旋转对称轴,近似对应于两个亚基。辅助因子的对称轴和LM亚基实质上是等价的。在5个跨膜螺旋的等价C原子之间的平方根偏差为1.3 ?的情况下,通过180°的旋转,把M亚基重叠在L亚基上面,惊人地发现了两个亚基的相似性。H亚基形成一个明显的球状单元。和L及M亚基的细胞质侧面进行广泛接触。这种接触可以稳定反应中心的结构。当除去H亚基时,降低了电子由QA-向QB的传递。这可能是由于复合物的松散,降低了QB的结合常数。Rb. Sphaeroides的反应中心的周质侧面,是细胞色素C2的剪切位点;它作为第二个供体,就是说;细胞色素C2释放电子到氧化的细菌叶绿素二聚体中。在RPS. Viridis中,固定在LM复合物周质侧的细胞色素,形成了反应中心的一个整体部分。
不能用X - 射线衍射直接测定与膜关连的反应中心,因为围绕反应中心的多数去垢剂分子是混乱的,不能形成可见的电子密度。反应中心的定性的中心区,不存有带电残基,被假定是处于膜内。为了更准确的确定反应中心和膜之间的关系,我们利用了艾森伯格(Eisenberg)和麦克拉克兰(Mc Lachlan)的能量函数,对和疏水的膜脂及亲水的外部溶剂有关系的反应中心的表面原子之间相互作用的能量进行了计算。通过系统地修改转化和反应中心的方向;确定了它在膜中能量最小时的位置#发现对称轴和膜平面是垂直的,位于反应中心内40?的疏水区中,并被鉴别和原生质膜的脂肪相连。由X - 射线衍射得到的结构证实了在结晶前所推论的主要特征。
辅助因子的电子结构
业已应用了几项光学和磁学共振技术,对反应中心的电子结构进行了探测。特别是,电子 - 核双共振,提供了参入到最初光化学反应中的未配对价电子的有关信息。这些信息,用X - 射线结晶学是无法获得的,根据是核电子的衍射。更特别的是,电子 - 核双共振测定价电子自旋和周围核自旋之间磁学相互作用的长度,这就产生了自旋密度图和未配对电子的电子波函数。
对于最初的供体D+,中价体受体ΦA-,受体Q A-和Q B-,都用ENDOR进行了实验。已使用了从这些实验得到的电子密度,去核对辅助因子分子轨道计算的精确度,并用于计算电子转化速度。也可以应用ENEOR测定空间结构的特征,例如氢键,用X - 射线衍射是无效的。结果表明,醌的两个羰基氧就是用氢键连接的,并测出了O……H的距离,精确度达0.1?。
在对电子结构的研究中,已经应用了光谱、红外和喇曼光谱学的有关知识。其中对电子传递理论最有意义的,是光谱上面的电场效应(Stark effect—斯塔克谱线磁裂效应),业已发现细菌叶绿素二聚体的红外带上的Stark effect,较其他带大几倍,这与在最初的电子转化过程中出现激发电荷转化态的情况是相符的。
结构 - 电子传递的关系
电子转化反应的速度和特性,关键在于辅助因子的空间排列。按照马库斯(Marous)的通论,决定两分子间直接电子转化的因素有三个:两分子电子密度(波函数)的重叠;分子的氧化还原电势差;重建能的数量,涉及到在丢失或得到一个电子之后的分子周围的原子重排时的能量问题,后者的一个例子,就是溶剂的双极在由电荷所产生的电场中重新定向。按理论预测,当重建能和氧化还原能差相等时,最大电子传递速度出现(对于一定的重叠),在这些条件下,该过程与温度无关。反应中心内的几个电子转化反应满足了这个条件。计算电子密度重叠,需要知道空间和电子结构,辅助因子间的距离改变1 ?,能使直接的电子转化速度发生数量级的变化。氧化还原电势通常是用实验来确定。重建能往往难以计算准确,但它并不像重叠对转化速度是那样至关重要。
电子传递反应的一个重要特点,就是首先沿A股进行。这起因于双折对称在反应中心结构的几个地方破裂。首先,在二聚体结构中固存着不对称,四吡咯环的其中之一比起其他来就不是平面(更加重叠);而且在Rb. Sphaeroides中,两部分镁的配位是不同的;第二,二聚体和BA的重叠程度大于和BB的重叠程度;第三,细菌脱镁叶绿素φA靠BA的距离比φB靠BB的距离少1.5?;第四,在两股中,辅助因子和蛋白质骨架的详细结合是不同的;第五,带电氨基酸的分布是不对称的。最后,植基(叶绿基)和类异戊二烯链并不遵循双折对称规则。这些不对称结构中的一些,对电子转化速度所产生的影响,已从Rps. Viridis的反应中心中计算出来了。沿A股的速度和沿B股速度的比值是45,这和>20的实验结果是一致的。
最初电子由D*φA→D+φA- 么在约3ps(ps—微微秒)时间内完成。D和φA的四吡咯环中心间的距离是17 ?,对于这样一个相对大的距离和相应小的电子密度的重叠来讲,如此短暂的时间实在是不好解释。所以,就利用了桥连单体BA对所观察到的转化速度进行解释。在一个最简单的图内,提出了两步顺序机制,把BA-看作是一种瞬间的中介体状态,但这种状态利用飞秒(飞秒—毫微微秒,10-15)光谱学是看不到的。这可以通过假定D+BA-φA→D+BAφA-一步远快于3ps进行解释,形成了不可测的另外还提出了一种“超交换”机制,即D*和φA之间的电子的重叠,得到实际状态D+B-的有效加强。除BA之外,其他桥连分子可在电子传递过程中发挥作用。例如,在D和φA之间,在Rb. Sphaeroides的M210上及Rps. viridis的M208上存有酪氨酸,另有一个DA的植基链,制造了和φA的范德瓦耳斯(Van der Waals)接触。这样,重要第一步的详细机制有待阐述。
电子由么φA-向QA转化,与温度无关,在Rb. sphaeroides和Rps. Viridis中的明显时间都是约200 ps。在Rb. sphaeroides的M252上和在Rps. Viridis的M250上色氨酸的芳香环近似的和醌环平行,而且和φA和QA是范德瓦耳斯接触,所以,它很可能在电子转化过程中起重要作用。plato等人根据在QA的还原中作为挢连中介体的色氨酸的空间结构,从理论计算中得出了结论。通过特异位点突变,用缬氨酸取代Rhodobacter Capsulatus反应中心的色氨酸,惊人地降低了光合成物的生长。因为关于这个突变体的反应中心的空间结构和电子从φA-向QA的转化速度均无报道,所以对该结构和这种效应的动力学基础有待确定。
电子由QA-向QB的转化,约在100μs内完成,因为在Rb. Sphaeroides中的两种醌都是泛醌,所以矢量电子从QA-向QB的转化,必定是起因于醌环境条件的差异。相对来讲,QB-的能量较QA-的低。两种结构差别,可造成QB-的能量降低。在QB的附近比在QA附近存有更多的极性残基,将通过双极的相互反应降低QB-的能量;而且在Te2+和QB比和QA靠得近,结果由于金属离子的阳电荷的静电势能使QB-相对于QA-的能量降低。在Rps. viridis中Fe2+是更对称地固定在QA和QB之间。在这一系统中,矢量电子由QA-向QB的转化问题,可以用甲基苯醌(QA)和泛醌(QB)之间氧化还原电势的固有差别进行解释。
电子由QA-向QB的转化速度,有560 meV的活化能。这样大的活化能,可以用在QB结合位点上存在极性残基进行解释。按照马库斯的理论,在QB-附近,和这些残基相连的双极的重新定向,将使重建能提高到远大于QA-QB和QA QB-之间自由能的差额,导致了相对离的活化能。
与电荷从QA-向QB转化相关的跨膜电势无变化,是与该结构是一致的。表明,醌的中心线的结合,近似地和膜的表面相平行。相反,而且也和结构相一致,电子从D*向φ和从φ-向QA的转化,伴随着横膜电势的变化。
QB-和D+间直接的电荷重组速度至少要比QA-和D+间的重组速度小两个数量级,虽然两个醌离二聚体是接近等距的。这种差别的最大的可能性解释,在于QB-和D+的直接的重组是一个热激活过程,而QA-是与温度无关。虽然差别被认为是由于在QB结合位点上存有极性残基;另有一种观点认为,通过蛋白质的重组是沿不同的路线进行。
为什么向前的电子转化速度远远大于重组速度呢?这个重要问题涉及一致量子产额,对这种现象已提出了几种解释。①向前的反应得到定位适当的中介体,例如辅助因子或氨基酸残基的帮助;②包括在向前反应中的态对电子之间分子轨道重叠,比起电荷分离态,更适于向前的反应;这是因为随着电子向QB进行,电荷对之间的距离明显拉大,③伴随电荷分离,构形发生改变,使其更不利于重组;④和两个连续电子转化态之间能量差相比,电荷分离和基态之间的能量差较大,能够在一定条件之下(如重组能小时)导致速度降低。计算电荷重组速度的工作相对来讲做的很少,所以向前速度和向后重组速度的大的比值问题,仍是悬而未决。
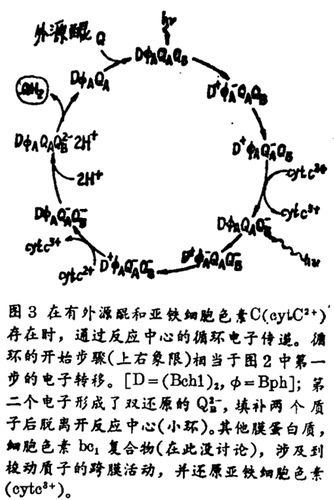
由QB2-的质子化所紧接的电子转化步骤。至此我们所讨论的,仅是限于由第一个电子的转化所引起的电荷分离的动力学。但是,和图2所示的最后电荷分离的种(Bch1)2+Bph QAFe2+QB-有关联的静电能,不能直接转化成化学能,也就是不能转化成ATP(腺苷三磷酸)。按照化学渗透理论,需要一种横膜的质子梯度;而这种梯度的形成,只有在第二个电子把QB-还原为QB2-之后。双还原的醌填充两个质子形成QH2,脱离反应中心,并由一个外源中性醌取代(图3)。这是一个需要外源醌和细胞色素C2参与的循环过程。在第二个光子能被吸收以前,D+必须被还原;这项任务是由细胞色素C22+所完成(图3右下象限)。标准循环时间是10-3s。
和QB2-的质子化有关联的主要问题,涉及到质子向双还原的醌转化的机制。提出了一个模式,认为质子由外部溶剂转化到QB2-,是通过一个可质子化的残基链,一个类似于“相位稳定区簇(bucket brigade)”的过程。反应中心的结构表明,两条残基链能够形成由QB2-向外部的质子桥。为了对这种机制进行研究,通过特异位点突变技术,用谷氨酰胺取代了靠QB最近可质子化残基的L212位上的谷氨酸。在这个突变体中的循环速度降低了一个数量级还要多,有力证实了QB2-的质子化,与L212位上的谷氨酸密切相关,这就有可能通过这种技术,完全定位质子化的路线。
展 望
现在已确定了反应中心的空间结构;在对辅助因子的电子结构的认识方面业已取得了进展。目标就是定量认识各种电子转化步骤,工作在不断进展。但是,开始电子传递步骤的机制问题,仍有待确定。究竟是“超交换”还是“两步”过程还不清楚。理论上指示,动力学上的应用电场效应,可在两者之间作出选择。据此所进行的初步的实验结果,似乎更赞成“超交换”。另一个未解决的大问题,关系到插入的氨基酸、植基和类异戊二烯链的作用问题。这个问题的解决,无论是在理论上还是在实验中,都要依靠特异位点突变技术。但是,在能够区分开改变残基的直接影响和结构改变所造成的间接影响以前,必须确定突变体的空间结构。
由于所计算的电子传递动力学和结构的详细情况密切相关,所以急需提高配位体测定的精确度。况且,迄今由X - 射线衍射所得到的,只不过是反应中心的中性和基态的“静态图”有实验证据说明,在电荷分离的同时,伴有结构的变化。原则上看,可以用由脉冲衍射技术所形成的同步加速器辐射进行研究。在理论上,是通过分子必威在线网站首页网址 学的计算,对反应中心的结构动力学进行了研究。实验中,有关必威在线网站首页网址 方面的信息,将从与温度有关的结构参数中得到。但对反应中心来讲,目前尚无有关这方面的实验报道。
总的来讲,我们对细菌光合作用最初过程的认识,为绿色植物光合作用、能源以及膜蛋白质的研究开辟了光辉前景。把细菌系统和更复杂的绿色植物中的光系统Ⅱ进行比较,不难看出,在细菌反应中心的辅助因子以及L和M亚基与光合成系统Ⅱ的D1和D2亚基之间,存在着相似性。尤其是,和辅助因子形成配位体的大量残基,以及稳定蛋白质的某些残基,都是高度一致的。在特异位点突变技术中,已利用了所假定的细菌的反应中心和光系统Ⅱ之间的结构相似性标定残基。作为能源,反应中心在量子产额和能量转化效率(-30%)之间不可能很好地兼顾。对电子传递过程的定量认识,使得提高RC(变化率)成为可能。并设计出在某些方面超越自然RC的模式系统。
[Nature,1989年3月11日]