嗅觉受体可能与眼睛视网膜上的受体和人体内许多激素受体相似,也是由蛋白质组成的,且有两个共同特征。一个特征是,受体位于细胞表面,并可自由进出细胞膜,这有助于受体与细胞外的分子发生作用,把信息传递到细胞内部;另一个特征是,受体都与一种具有信息传递作用的特殊蛋白——G蛋白相连接。
历 史
在过去20年里,嗅觉的分子生物学研究得到了迅猛发展。图1以cAMP途径为例显示了这一发展的历史进程。现在,我们对嗅质*识别的认识已从纯猜测状态上升到一个全新的阶段,现在可以鉴定和克隆出参与感觉和传导的成分。
许多年来,嗅觉研究一直落后于生物化学研究的其他领域,其主要原因在于嗅质世界的高度复杂性。有效嗅质的数量多以百万计,比所有其他种类膜受体的配体的总量还要大。嗅质识别令人有些不易捉摸:一个嗅质可激活许多不同的感觉细胞,而每个感觉神经元也可被许多嗅质激活。目前最广为接受的理论是,嗅质识别过程由大量的受体蛋白质参与,它们具有不同但是部分重叠的特异性。在分子克隆方法出现之前,单凭药理学研究,要定义受体亚型(subtype)是很困难的,即使是定义乙酰胆硷或生物胺等已为人所熟知的配体的受体亚型也不容易。因此,对嗅觉过程中复杂得多的受体识别性质至今仍捉摸不清,这并不令人感到惊奇。
嗅觉第二信使和信号传导
因为嗅受体的复杂性,已有许多实验室在致力于探索其放大和化学——电传导等后受体事件(postreceptor events)中的分子元件。有一种这类传导级联(transduction cascade)的蛋白质已得到完全鉴定,并且,有关基因的分子克隆也得到描述(图1)。这种传导级联包括一个刺激性GTP结合蛋白,一个腺苷酸环化酶和一个受第二信使cAMP调控的阳离子通道。有大量的电生理证据支持这一机制。
图1 对嗅觉传导和终止的理解的历史进程。OR. 嗅觉受体; OBP.嗅质结合蛋白;G.嗅觉GTP结合蛋白(Golf);AC.嗅觉腺苷酸环化酶(AColf);Ch. 嗅觉cAMP调控通道;PK-A. cAMP依赖性蛋白激酶;P-450,嗅觉细胞色素P-450 olf1;UGT.嗅觉UDP glacuronosyl tranferase(UGTolf);GST.谷胱甘肽S转移酶。图中浅色阴影代表已被鉴定为功能成分但未克隆的蛋白质;深色阴影代表cDNA或基因已得到克隆并且只在嗅上皮中表达的蛋白质。
在鱼和昆虫中发现另一种传导级联,它包括一个不同的G蛋白和一个磷脂酰肌醇磷酸脂C。受肌醇三磷酸(IP3)调控的质膜阳离子通道或者依赖蛋白激酶C的二酯酰甘油(DAG)是这个途径第二信使的靶。鸟苷酸环化酶和cGMP调控通道也可能是这种机制的组成部分之一。目前,这种嗅觉磷酯酶C途径的所有成分都有待于鉴定及分子克隆。
由于G蛋白参与以上两种途径,因此,有人提出将嗅觉受体归于与G蛋白结合的7次跨膜结构域受体超家族。研究只在嗅上皮中表达的7次跨膜结构域受体的许多基因的分子克隆所得的结果支持了这一观点。
嗅质识别和随后的反应级联
下面的描述既适合于恒定嗅质浓度与分子受体之间的平衡态,同样也适于存在嗅质脉冲时的稳态。
嗅觉开始于嗅质配体(L)与跨膜受体(R)之间的结合。在平衡态(或稳态)时,必然存在一定浓度的配体-受体复合物(RL),其浓度受结合常数K控制。如果配体是一个激动剂(agonist),RL复合物将获得一定的酶活性,在许多G蛋白活性位点上催化GDP转化为GTP,G-GTP的稳态浓度将会增加,并且,由于每个活性G-GTP分子与一个效应酶(effector enzyme)(例如腺苷酸环化酶)结合,从而后者的活性增加。结果,第二信使(在此情况下为cAMP)的浓度增加,更多的受cAMP调控的离子通道被打开,从而产生了感觉电流。
嗅觉脱敏作用
对于嗅觉系统,如果L浓度为稳态,从而导致RL、G-GTP和cAMP的浓度也为稳态,其输出信号就会因为脱敏作用或适应过程而减小。在分子水平上,可能在几个环节上出现这种情况,包括作为G蛋白激活剂的功效的减弱,以及cAMP结合通道打开几率的减小。这种脱敏作用与同其他G蛋白结合的受体和配体调控通道有共同之处,通常通过蛋白质磷酸化进行调节。
克隆排斥(clonal exclusion)
嗅觉神经元为双极神经细胞,其功能是接受嗅质信号并向脑传递动作电位,它们对嗅质具有选择性。并非所有嗅质能够激活任何细胞,也并非所有细胞能对任何特定的嗅质产生反应。另一方面,一个细胞——一个嗅质的关系也不太可能成立,因为细胞类型数目(不超过1,000)不足以与挥发性有机物总数(约为1,000,000)相匹配。最有可能的方案是每个受体类型可以识别许多嗅质。这种受体多特异性(multispecificity)异乎寻常:几乎所有已知受体都能够结合几十个天然和人工配体。从而,嗅上皮上每个单一感觉细胞的宽嗅质谱可能反映了感觉细胞上单一受体类型的混杂性(promiscuity)。换言之,嗅觉受体的克隆排斥,类似于B和T淋巴细胞受体,这与单细胞的电生理学研究结果一致。然而,每个嗅觉神经元是否确定只具有一种受体蛋白,还需要进行标记研究,例如,嗅觉神经元是否像B和T淋巴细胞一样为克隆排斥的呢。
嗅觉信号的终止
定义
嗅觉信号的终止是与信号的产生和脱敏作用相互独立但仍有一定关系的一类不同的现象,它与嗅觉途径对激动剂浓度降低的反应方式相关。由于小嗅质配体的解离速度常数通常较大,RL浓度将在很短时间内快速降低。结果,G蛋白的GTPase活性丧失,同时与其相偶联的腺苷酸环化酶的量也减少。cAMP浓度在磷酸二酯酶的作用下降低,cAMP通道关闭。
以上描述的过程发生的先决条件是受体周围的配体浓度按适当的时间常数降低,而事实上这种降低并不能自动发生。在激动剂为脂溶性时(如绝大多数嗅质)便是如此。这些配体会很快地分配进入所有细胞膜结构,随后缓慢地释放到液体相中,产生一个伪延长反应(artefactually prolonged response)。其他的信号系统具有激动剂中和和/或消除机制。例如乙酰胆硷酯酶和生物胺的吸收。
问 题
(1)所有的化学构型都经过了酶修饰,需要多个酶或特异性范围很宽的酶参与。(2)嗅质修饰的产物应该不具有嗅刺激性。从而,嗅质乙酸戊酯的酯酶作用是无效的,因为其产物(戊醇和乙酰)也是嗅质。
嗅觉Glucuronosyl Transferase
嗅上皮也具有特定的UDP glucuronosyl transferase(UGTolf),并已在两种动物(鼠和牛)中定义了UGT的一个新成员。这个酶的一些特性支持了它在嗅质信号终止过程中的作用:(1)它只存在于感觉上皮上,在邻近的非感觉(呼吸)上皮或其它组织里不存在;(2)它在嗅组织中含量很高,与之相关的糖蛋白gp56,是嗅上皮膜抽提液的三个主要电泳带之一;(3)嗅上皮中的酶,偏向于对嗅质起作用;(4)嗅质经UGTolf的葡糖醛酸化以后,不再能激活嗅传导酶级联;(5)它比非感觉同类具有更宽广的特异性;(6)在对嗅上皮分离块所进行的实验中发现,嗅质渗透进组织中,进而被UGTolf修饰,并且以与葡糖酯酸结合的方式被内在化;(7)UGTolf的动力学反应很快,足以使嗅质在感觉系统的必威在线网站首页网址 范围内完成结合过程。
嗅觉生物转化酶的细胞定位
要确定嗅觉生物转化酶的功能,关键在于对它们进行细胞定位。在鉴定嗅觉特异亚型之前,先利用肝脏中酶的抗体,结果发现嗅组织中有两个区域被标记上了:一个是厚度为20~30 μm的表层,另一个是亚上皮结构(subepithelial structure)亚上皮结构很容易地被鉴定为Bowman腺的分泌细胞。表层似乎与嗅纤毛或树突无关,而与嗅支持细胞的顶端区域相联系,支持细胞的功能类似于其他神经组织中的胶质细胞。另外,在一些动物中它们还具有分泌功能。
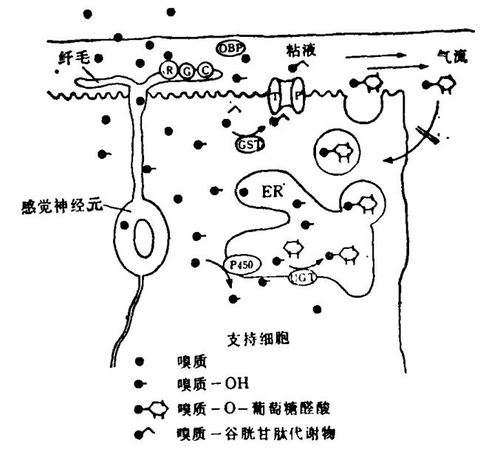
生物转化酶通常存在于内质网的细胞内膜上,这一点与嗅觉酶一致,嗅觉酶通常存在于嗅上皮的微粒体膜上。嗅生物转化酶定位于两类分泌细胞的细胞内膜上,这一点值得注意。由此我提出了如图2所示的模型。模型指出,在确定时间内没有与受体结合的过剩的嗅质分子会以被动扩散的方式穿过一些膜到达非神经细胞中,与酶结合,进而可能被生物转化。除去这些生物转化产物的关键是分泌。这种生物转化-分泌耦合方式可能很普遍,并且可能也存在于其他组织中。
图2嗅觉生物转化酶功能模式的假设模型。R.受体;G.G蛋白;C.腺苷酸环化酶;ER.内质网;TP.转移蛋白。
值得强调的是,嗅觉生物转化酶作为信号终止物的作用并不排斥它们在解毒过程中的作用。嗅神经上皮是高度暴露的神经组织。空气中的化学物质可能与病毒和病原体一起穿透嗅上皮进入脑,产生神经毒效应。细胞色素P450、UGT和GST等形成的酶屏障可能协助避免这些化学损伤。
嗅觉信息加工
当前比较流行的看法是:嗅质编码通过受体激活值(activation value)的综合效应实现。一个特定的嗅质会以或强或弱的亲和力与全部N个受体中不同的受体结合。而且,为了能被察觉,嗅质不仅要与受体结合,而且还必须充当至少一种受体的激动剂,即诱导受体产生适当的构象变化,以便激活G蛋白。更确切地说,嗅质必须产生一种嗅上皮中所有N个受体激活值(α1,α2,α3,…αn)的“载体”。αj是嗅质与第j个受体(Rj)的激活因子,是两个变量的综合结果,即嗅质与受体Rj的解离常数(或亲和常数)Kj,以及它们之间相互作用的“内禀活性”或激活度Ij的综合结果。一系列不同的感觉神经类型产生的全部活性模式定义了嗅质的品质(quality)和强度。
这种嗅觉信号加工和抽提(extraction)的最初阶段发生在嗅球上。中枢神经系统的这个区域包括嗅通路的第1突触层。这些突触是感觉细胞的轴突和次级细胞的树突之间形成的,存在于称为小球(glomeruli)的球状结构(宽度约100 μm)内。每个嗅球中有约106个初级神经元和102个次级神经元,会聚率为1000:1。很显然,这种高会聚导致了干扰的消除,从而这个系统有能力探测到非常微弱的信号。
嗅受体蛋白和基因
从猜测到事实
嗅受体蛋白的本质&使人们困惑了几十年(图1)。这主要是因为配体的多样性和缺乏药理学定义。过去10年中,我们对嗅觉传导理解的进展为进一步通过分子克隆的方法鉴定嗅受体基因创造了条件。正如人们所猜想的,嗅蛋白形成了一个多基因家族(约1000个基因),它们具有七次跨膜结构域结构,并且它们只在嗅上皮中表达。有趣的是,上述嗅受体多基因家族中的一个或一些还在精子中特异表达。它们在这些细胞中的功能尚未知,不过,可能与它们和外界化学信号特异识别相关。
目前,几个实验室至少已克隆出100个不同的嗅受体(OR)编码区。在同种动物中,这类受体具有40 ~90%的同源性。种间差异大一些,但并不显著。
公开的问题
嗅受体的克隆开辟了许多以前认为不太可能的研究领域。一个公开的重要问题是:OR克隆编码的蛋白质激活传导级联的能力如何?要回答这个问题最好进行表达实验。然而,尚不知道OR蛋白是否与嗅觉G蛋白之外的任何其它G蛋白发生作用,例如,是否和与腺苷酸环化酶偶联的Golf以及与嗅觉磷酸酯酶C偶联的G蛋白相互作用。从而,仅仅在真核细胞中表达OR cDNA并不能保证其功能。进一步说,即使与宿主细胞的内源性G蛋白发生偶联,而能否选择正确的嗅质配体与特定OR结合仍是一个问题。
另一个公开的问题与OR表达的调控相关。通常认为每个嗅感觉细胞表达所有OR基因的一个子集,而克隆选择为一个极端的情况。这种选择性表达是如何调控的?其机制可能与免疫球蛋白不同,因为OR基因似乎在其编码区不存在重组。如果OR确实存在于几个不同的染色体,那么这个问题将更加复杂。
人类嗅受体
OR DNA探针的获得使我们有可能首次将人类嗅觉生物物理学的丰富资料与分子基因数据相联系,人类OR基因可以很容易地从基因组文库中克隆出,因为这些基因在其编码区似乎没有内含子,从而这些基因组克隆对顺序比较和功能表达研究的意义与cDNA克隆一样重要。
[摘译自Sensory Transduction,第6章,1992,洛克菲勒大学出版社出版]
________________
* odor,—般译成气味、香气、臭气等,是嗅觉刺激物。为避免与味觉刺激物混淆,建议将odor译成嗅质。相应地,味觉刺激物可称为味质。——译注