虽然导致脱病毒疾病的感染原的确切结构还不清楚,但其分子遗传学重要特征已被阐明。从疯牛病到人的传染力强烈表明需要充分理解并重视朊病毒生物学。
可传播亚急性海绵状脑病(TSEs)——包括羊瘙痒病,牛海绵状脑病(BSE),克-雅氏病(CJD)在内的研究充满了困难。致病的传播因子(朊病毒)一直逃脱了试图明确鉴定它的所有尝试。而且它只能在实验动物中进行分析,由于从接种到发病的延迟期数以月计,实验的周转时间也限制了可供测试的思路数量。
大多TSE研究者信奉“唯蛋白”假说,该假说认为传播因子中没有核酸。但也有人继续相信这些疾病是由一种病毒引起。尽管困难重重,朊病毒生物学领域近几年来已取得了相当大的进步。我们这儿的主要目的不是去回顾这些细节,而是着重讨论最迫切的悬而未决的问题,并提供一些如何提出这些问题的思路。
请真正的Hyde*先生站出来好吗?
毫无疑问,一个首要的问题是要找出感染原的特征。相当多具体的证据(主要是遗传学方而的)支持唯蛋白假说。这个理论主要的体现是主张PrPC(—种见于所有已检测过的脊椎动物的脑和其它器官中的正常蛋白)可以通过某种自身催化过程转化成为错误折叠的病理形式(称为PrP*)。在该病的许多形式中,这一过程伴随着PrPSc的形成。PrPSc是PrP的一种不溶形式,大部分耐蛋白酶消化。斯坦利 • 普鲁西纳及同事提出PrP*和PrPSc是相同的,他们相信唯蛋白假说最好地解释了所有已经得到的证据。通过将1997年诺贝尔生理学或医学奖授给普鲁西纳,该观点现在已得到公认。但反对派仍然要求建立一个无懈可击的实验来说明朊病毒仅由蛋白组成。可是,就像波珀(Popper)指出的那样,一旦一个理论被证明是错的,它就再也不会被证实了。
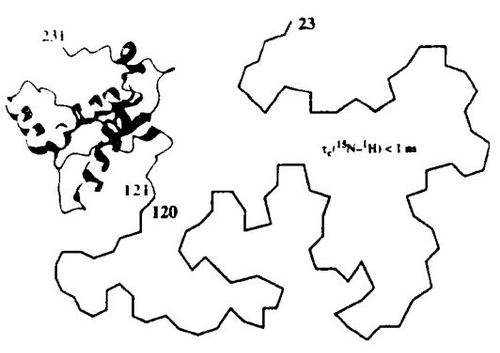
小鼠PrPC的三维结构已被大致搞清楚了(图1)。
图1在大肠杆菌中表达的重组鼠源PrPC的三维结构。意外的是氮端肽段的23-120是柔软而散乱的
它的碳端部分由三个α螺旋和一个β折叠片层组成,它们形成一个稳定的球状结构;氮端部分是随机卷曲。测定PrPC的结构很困难,测定PrPSc的结构更是如此。傅立叶变换红外色谱和圆二色性研究表明,PrPC约有43%的α螺旋和3%的β片层,而PrPSc的制备品约有34%的α螺旋和43%的β片层,提示β折叠结构域由N端区域结构破坏为代价形成。而且,纯化的PrPSc制备品是不溶的,里而搀杂了别的物质,其中包括一种未知的“聚集复合物”共价连接在脂肪酸上。如果核酸存在的水平和感染单位呈化学计量关系,它们肯定短于100个核苷酸,PrPSc制备品的溶解过程伴随着变性和感染力的丢失,虽然通过合适的变性可以能够再得到抗蛋白酶解的不溶PrP,但感染力却从未能够重新获得。
这些技术上的障碍阻碍了测定在PrPC向PrPSc转化过程中发生的结构变化。可能需要借助一些非常规方法,如可以导入和定位分子内交联来研究折叠变化。但主要的难题是感染单位与抗蛋白酶解分子的比率级数为1:100,000或更小。这是因为感染单位是由许多相同的PrP组成的聚集物吗?还是因为感染单位是不同的PrP混合物中一个小而独特的成分?利用一种很少或没有PrPSc,但感染力却很高的朊病毒疾病模型,对于找到更易控制的系统可能是很有价值的。
功能探索
正常朊病毒蛋白的生理功能至今未能阐明。没有PrPC的小鼠发育正常,奇怪的是,仅有极少缺陷。有种叫长期电位(据推测对短期记忆和学习很重要)的突触现象被破坏了,但没有发现行为参数的变化。这些小鼠也产生异常睡眠方式。一个没有PrP的小鼠系在年老时出现小脑神经原退化,但它与缺乏PrPC的因果关系尚待证实。
那么为何一个非必需基因能在进化过程中保存下来呢?可能它的功能在实验室的条件下觉察不到,但在野外却能带来选择优势。也可能PrPC功能可被其它结构迥异的蛋白替代;推测胚胎发育时这些蛋白在没有PrP的情况下可能受到正调控。要想找到它们,应该比较野生型和PrP剔除小鼠的信使 RNA和/或蛋白质。
由于PrP的位置是由磷酸肌醇糖脂锚定在细胞外表面,它是一种具有信号传导或运输功能的候选蛋白。虽然已有几个候选配体报道,但在体内尚未证实其相互作用。在遗传实验的基础上,普鲁西纳及其同事推测一个“蛋白X”可能与PrPC相互作用并在其向PrPSc转化中起重要作用。鉴定这个蛋白并测定它的功能(可能是一种伴娘蛋白,帮助介导蛋白折叠)是最令人感兴趣的问题。
一个启发性的想法是PrPC的功能可能与它可以形成不同的构象有关,因为它有长、松散而柔软的尾巴。也许这种柔性的代价是倾向发生少量的转化而成为致病形式。一种PrPSc相关形式可能与PrPC处于平衡状态,“晶种假说”认为当这种产物浓度超过一个特定浓度,就可形成稳定的PrPSc聚集物并迅速凝集别的单体。
虽然这些特征在TSEs中会带来致命后果,但在别的背景下可能是有益的。如酵母Saccharomyces cerevisie的{psi}状态中,多肽链释放因子(cRF3,也写作sup35p)可以通过“类朊病毒”过程转化为无功能的聚集物。这可以抑制其它致死的无义突变。同样在酵母中,Ure2p蛋白可以以无活性的聚集状态存在,它以相似的方式传播,这在特殊环境下有选择优势。所以“朊病毒原理”的存在可能比现在意识到的更为广泛。
朊病毒和脑损伤
对朊病毒引发脑损伤的机制所知甚少。它们导致神经细胞空泡化和死亡,星形细胞和小神经胶质细胞激活,统统造成致命的脑电功能损伤。首先要确定损伤是由病理性朊病毒蛋白积累所致,还是因为正常形式耗尽造成。虽然没有PrP的小鼠是健康的,但这可能是因为它们从早期发育时起已有时间来适应无PrP的生活,一个关键的实验是把朊病毒基因“条件性剔除”,使PrPC在成年小鼠中的表达突然关闭。
另一方面,如果我们承认PrPSc沉积是病理发生中的主要事件,那么为何即使在疾病晚期,在很多人和实验性的TSE中也只能检测到极少(假如有的话)的PrPSc?PrPSc沉积必须从细胞内起作用,因为没有PrPC的神经细胞不被细胞外PrPSc感染,哪怕经过长时间的接触。
我们还需要知道中枢神经系统(CNS)的不同细胞类型在TSE病理发生中所起的作用。主要目标看来是神经原,但在TSE中并非都能见到神经原显著减少。而星形细胞激活倒发生得很早,导致一些生理效应如血脑屏障受损,因为星形细胞可以支持朊病毒复制,搞清楚这种细胞类型如何参与TSE病理发生是一个很有趣的问题。越来越多的证据表明脑损伤也涉及到小神经胶质细胞,不仅在TSEs中,在其他疾病,从早老痴呆病到多发性硬化,甚至中风中都有发现。在TSEs中小神经胶质细胞激活可能对产生神经损伤很重要,其激活依赖于PrPC的表达。但这种细胞死亡途径的细节以及发病过程中脑子里(不仅在有体外培养细胞的培养皿中)发生这些现象的证据尚未找到。
朊病毒行进到脑的历程
朊病毒直接进入宿主的脑时最有效,但这并非通常的感染途径。在人中,大多克-雅氏病传染是源于肌内注射朊病毒污染的垂体激素。同样,巴布亚新几内亚的库鲁病是由于在食人肉的宗教仪式上食入了感染成分。在动物中,一个新近的致命疾病是疯牛病,它是因朊病毒经口传播而导致的有相同来源的流行病。
很明显,朊病毒可以在体内找到进入宿主脑的途径,但除中枢神经系统外在别的器官还没能找到组织病理学变化,但在TSE的潜伏期,朊病毒可能在贮藏区悄悄地增殖,.这种贮藏区之一可能是免疫系统,许多研究都指出朊病毒在淋巴器官复制中的重要性。如第4型PrPSc在扁桃体的淋巴组织中大量积累,很容易用抗体在组织切面上检测到。在经口摄入朊病毒之后,小肠的集合淋巴结中几乎马上有感染力的积累。
淋巴网状内皮细胞系统(LRS)中支持朊病毒复制的细胞的性质尚未确定。PrPSc在野生型小鼠和裸鼠(选择性T细胞缺陷)的淋巴小结树状细胞中积累。而用耐受的骨髓移植(不能有效地替换淋巴小结树状细胞),把野生型细胞转入没有PrP的小鼠中可以恢复感染原在脾中的积累。免疫细胞好像不会把感染原从淋巴网状内皮细胞系统一直运送到中枢神经系统;感染原很可能通过周围神经系统扩散,就像狂犬病和疱疹病毒那样。我们正在检测腹膜内注射的朊病毒是否会先被淋巴网状内皮细胞系统细胞带到周围神经末梢,然后再穿过突触沿着纤维束进一步扩散。
抗朊病毒的羊群和牛群?
没有PrP的小鼠正常、健康且抗朊病毒疾病,这个发现直接提示可生产没有PrP的羊和牛。它带来了两个问题:第一,基因剔除是否可在畜牧动物中进行,是否与小鼠中得到的结果一致;第二,这样做是否有用且可行。
疯牛病爆发于80年代中期,1992年达到顶峰,由于采取了禁止牛食用反刍类的骨头和肉制饲料的措施,疯牛病现在正迅速减少。事实上已确定年轻人中发生的变型克-雅氏病悲惨病例是源于疯牛病原。因为潜伏期很长以及其他未知因素如遗传倾向性和接触标准等,我们尚不能评估变型克-雅氏病的发病率是否会上升,或上升到何种程度。我们需要知道疯牛病是会完全消失,还是会成为地方性动物病(经常性地感染某一特定地区或季节的动物),就像瘙痒病一样。假如是那样的话,必须要将其根除。
羊瘙痒病是英国地方性动物病。每年感染0.5~1%的羊群,根据流行病学资料,感染羊的瘙痒病并不使人致病。但从疯牛病在实验条件下可经口传播给羊来看,羊可能已于80年代中期在饲养过程中受到感染,故一些明显的羊瘙痒病实际上可能来自疯牛病原。那么食用病羊成分对人类健康是一个危险,故有必要消灭瘙痒病。
所以在有些情况下,没有PrP的牲畜是必要的。在羊中应当找出适当的技术以验证原理,在牛中可能也是这样,但在实践上,替换许多不同种系同时保留遗传异质性的困难在于要生产和预生产大量的遗传修饰动物,这确实是一项令人望而生畏的事业。也许商业上可行的第一步是生产抗朊病毒的动物来作为重要药物产品的来源。
药物开发
到海绵状脑病初症被发现时,中枢神经系统已发生了相当大的损伤。虽然目前只有数量有限的变型克-雅氏病例,但不能用它来预测将来的发病率。这儿,接触后预防比治疗明显的临床疾病更有希望成功。因此,一旦疯牛病引发的病例增加,采用非侵袭或最少侵袭,且价格可以接受的大量筛查程序是必需的。分离PrPSc特异性的单克隆抗体,用来检测扁桃体刮片为这一目标的实现提供了一条捷径。
治疗策略有几种可能目标。假如发育后除去PrP没有危害后果,那么降低PrP水平可能使发病变慢或停止。原理上,这可以用反义寡核苷酸来实现,但有效的转移仍然是个棘手的难题(尤其是在脑内)。第二个目标是抑制PrP转化为与致病原相同的形式,也许可以通过干扰PrPC、PrP*或蛋白X之间相互作用时涉及的分子结构域来实现。最后,假如富含β片层的结构域确实形成有感染力的部分,就可以用与其亲和的化合物破坏PrP致病形式或使之失活。
几种物质给治疗带来了有限的希望——两性霉素、硫酸化多聚阴离子、刚果红和氨茴环霉素等。两性霉素的作用机制还不清楚,但别的化合物被认为是结合、插入或破坏了PrPSc高度有序的结构。不过,所有已测化合物的效果都很轻微。而且TSEs未能吸引制药业的大量投资,毫无疑问,这是因为它们在人类中太罕见了,没有商业诱惑力。但在最坏的情况下,疯牛病爆发可以使人类的TSEs流行病学发生相当大的改变。
因为新药开发所需时间正在减少,而预测的人类流行性疯牛病可能在10~20年内达到顶峰,所以开发治疗药物是及时的,也是迫切的。如果工业界不付出努力的话,我们相信英国政府应当同意资助鉴定治疗药物,提供原理验证的课题。政治家们应该考虑到自己对已接触疯牛病原的人们所负的责任。
—————————
*:见于英国作家Robert Louis Stevenson(1850-1894)的小说《Jekyll博士和Hyde先生的怪事》。Jekyll博士是一位善良的博士,他发明了一种药物,可以使自己变成邪恶残忍的Hyde先生。此处喻朊病毒蛋白的双重作用。
[Nature,1997年10月23日]
朊病毒研究:接下来的前沿
发布时间:98年01月24日
必威体育备用地址
目录 contents
卷首语
本刊特稿
物理学
宇宙学
化学
生物伦理学
医学伦理学
医学
信息技术
今日启明星
新技术